Hoe werkt een accu?
Eén van de belangrijkste toepassingen van elektrochemische cellen is als stroombron. In principe kan iedere elektrochemische cel dienst doen als stroombron. Een voorbeeld is de loodaccu.
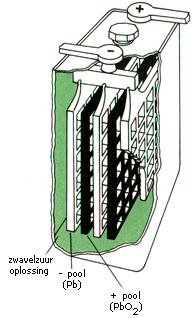
De accu die vooral bekend is uit auto's, is opgebouwd uit zes cellen die in serie zijn geschakeld. Per cel zijn er twee loodplaten waarvan er één bedekt is met lood(IV)oxide. De loodplaat werkt als reductor en zorgt voor de vorming van de negatieve pool. Het lood(IV)oxide werkt als oxidator en zorgt voor de vorming van de positieve pool. De accu is gevuld met een oplossing van verdund zwavelzuur die dienst doet als elektrolyt.
Voor de halfcel met de reductor geldt:
Pb (s)+SO42− (aq)\(\rightleftarrows\)PbSO4 (s)+2 e−
Voor de halfcel met de oxidator geldt:
PbO2 (s)+SO42− (aq)+4 H++2 e−\(\rightleftarrows\)PbSO4 (s)+2 H2O (l)
Na verloop van tijd zal de accu zijn uitgeput. De loodplaten zijn dan geheel bedekt met lood(II)sulfaat. Het is mogelijk om een loodaccu weer op te laden. Dit doet men door middel van elektrolyse. Als beide polen van een accu worden verbonden met de overeenkomstige polen van een externe spanningsbron dan zullen beide halfreacties in omgekeerde richting gaan verlopen. De accu wordt op die manier weer opgeladen.