Hoe werkt elektrolyse?
In een elektrochemische cel verlopen redoxreacties die ervoor zorgen dat er na verloop van tijd stroom wordt opgewekt door de cel. Bekende voorbeelden hiervan zijn accu's en batterijen.
Het is ook mogelijk om redoxreacties te laten verlopen onder invloed van een externe spanningsbron. Kijk eens naar de volgende cel. Je ziet twee halfcellen met elkaar verbonden door middel van een zoutbrug. In iedere halfcel bevindt zich een elektrode die verbonden is aan een externe spanningsbron.
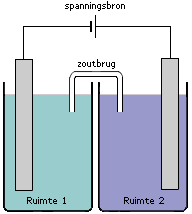
Als de spanningsbron wordt ingeschakeld zal zowel ruimte 1 als ruimte 2 onder spanning komen staan. De elektrode in ruimte 1 is verbonden met de - pool (het 'kleine' verticale streepje is per definitie de - pool). De elektrode in ruimte 2 is verbonden met de + pool (het 'langere' verticale streepje is per definitie de + pool). De manier waarop er elektrische stroom gaat lopen in een elektrolyse cel kan in een aantal stappen worden onderverdeeld:
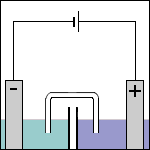 |
Stap 1 Omdat de elektrode in ruimte 1 is verbonden met de - pool van de externe spanningsbron wordt deze elektrode dus negatief geladen. De elektrode in ruimte 2 is verbonden met de + pool en wordt daarom positief geladen. Voordat er reacties optreden hebben de beide elektrodes dus al een lading. |
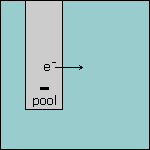 |
Stap 2 Omdat de elektrode in ruimte 1 negatief geladen is, heeft deze elektrode een overschot aan elektronen. Deze elektronen worden afgegeven aan de oplossing. |
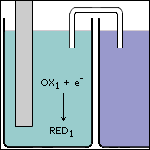 |
Stap 3 De afgegeven elektronen reageren met de sterkste oxidator die in ruimte 1 aanwezig is. |
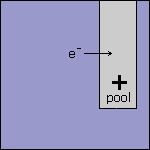 |
Stap 4 Omdat de elektrode in ruimte 2 positief geladen is, heeft deze elektrode een tekort aan elektronen. Deze elektronen worden afgegeven door de oplossing. |
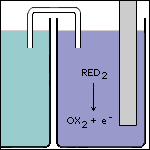 |
Stap 5 De enige manier waarop de oplossing elektronen kan afgeven, is als de sterkste reductor in ruimte 2 reageert. Dan wordt namelijk de geconjugeerde oxidator en een elektron gevormd. |
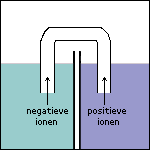 |
Stap 6 Doordat elektronen in ruimte 1 vrijkomen, zal deze ruimte na enige tijd steeds negatiever geladen worden. Ter compensatie hiervan (en om de stroomkring te sluiten) zullen kleine negatieve ionen via de zoutbrug van ruimte 1 naar ruimte 2 gaan. Andersom zullen kleine positieve ionen via de zoutbrug van ruimte 2 naar ruimte 1 gaan. De stroomkring is nu gesloten: de elektrolyse kan plaatsvinden. |
Het is belangrijk om te zien dat voordat de reactie begint de beide elektrodes al een lading hebben. Ze zijn al positief en negatief geladen voordat de reactie op gang is gekomen. Dit is dus precies andersom dan bij een elektrochemische cel.
Onthoud dat tijdens elektrolyse bij de (−)-pool altijd de sterkste oxidator en bij de (+)-pool altijd de sterkste reductor reageert.