Wat is elektronegativiteit?
Elektronegativiteit is een getal dat aangeeft hoe sterk een atoom elektronen aantrekt. Hoe groter de elektronegativiteit, hoe sterker een atoom elektronen aantrekt. De elektronegativiteit kun je opzoeken in Binas-tabel 40A of ScienceData-tabel 8.1.
Meer uitleg
De atoombinding tussen twee atomen in een moleculaire stof wordt gevormd door een gemeenschappelijk elektronenpaar tussen die twee atomen. Als voorbeeld kiezen we de atoombinding in een HCl-molecuul:
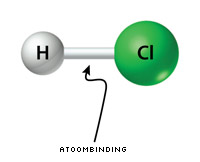
Het blijkt dat de elektronen in de atoombinding tussen het chlooratoom en het waterstofatoom niet precies in het midden tussen de twee atomen zitten. Eén van de atomen trekt de elektronen in de atoombinding meer naar zich toe. We zeggen ook wel dat dit atoom de grootste elektronegativiteit heeft.
Uit Binas-tabel 40A blijkt dat de elektronegativiteit van chloor 3,2 bedraagt. De elektronegativiteit van waterstof is 2,1. Het chlooratoom trekt dus sterker aan de elektronen in de atoombinding tussen de twee atomen dan het waterstofatoom. We kunnen dit schematisch weergeven door middel van een pijl. Deze pijl loopt evenwijdig aan de atoombinding en wijst naar het meest elektronegatieve atoom:
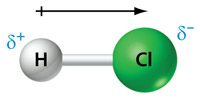
Het meest elektronegatieve atoom geven we aan met δ− en het minst elektronegatieve atoom met δ+.
Polaire atoombinding
In het voorbeeld hierboven zie je dat het verschil in elektronegativiteit (ΔEN) tussen de twee atomen 1,1 is. We noemen de atoombinding in een HCl-molecuul daarom ook wel een polaire atoombinding omdat ΔEN groter is dan 0,4.
Het verschil in elektronegativiteit tussen twee atomen geeft dus aan met voor een soort atoombinding je te maken hebt. Een verschil groter dan 0,4 duidt op een polaire atoombinding.
ΔEN ≤ 0,4 \(\longrightarrow\) gewone atoombinding
ΔEN > 0,4 \(\longrightarrow\) polaire atoombinding