Wat is een zout?
Zouten zijn stoffen die bestaan uit metaalatomen en niet-metaalatomen. Zouten zijn opgebouwd uit positieve en negatieve ionen. De metaalatomen leveren altijd de positieve ionen. De niet-metaalatomen leveren altijd de negatieve ionen.
Voorbeeld
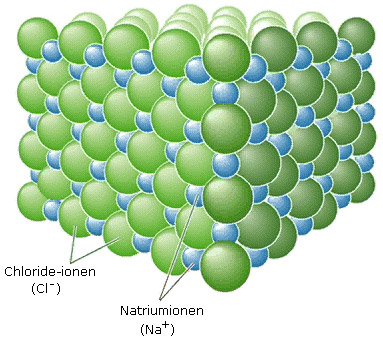
Het zout natriumchloride is opgebouwd uit positieve natriumionen en negatieve chloride-ionen.
Positieve ionen
De metaalionen (= de ionen die gevormd zijn uit metaalatomen) zijn dus altijd positief. Dit komt omdat metaalatomen veel gemakkelijker elektronen kunnen verliezen dan opnemen.
Hoe groot de lading van een metaalion is, kun je voor een deel afleiden uit het periodiek systeem. Zo hebben alle alkalimetalen (groep 1) een lading van 1+ en alle aardalkalimetalen (groep 2) een lading van 2+.
De meeste overgangsmetalen kunnen meerdere positieve ionen vormen. Zo kan een ijzerion een lading van zowel 2+ als 3+ hebben. Dit onderscheid geven we aan met een Romeins cijfer: ijzer(II) en ijzer(III).
Voorbeeld
Tin(IV) is Sn4+ en tin(II) is Sn2+.
Naast de enkelvoudige metaalionen (= metaalionen die uit één atoomsoort bestaan) zijn er ook samengestelde groepjes van niet-metaalatomen die een positieve lading hebben. Voorbeelden hiervan zijn NH4+ (het ammoniumion) en H3O+ (het hydroniumion).
In de onderstaande tabel staan enkele positieve ionen vermeld.
| lading | positieve ionen |
|---|---|
| 1+ | Li+, Na+, K+, Ag+, H+, H3O+, NH4+ |
| 2+ | Mg2+, Ca2+, Ba2+ |
| 3+ | Al3+, Au3+ |
| 1+ of 2+ | Cu+ / Cu2+, Hg+ / Hg2+ |
| 2+ of 3+ | Fe2+ / Fe3+ |
| 2+ of 4+ | Sn2+ / Sn4+, Pb2+ / Pb4+ |
Negatieve ionen
Niet-metaalionen hebben altijd een negatieve lading. Dit komt omdat ze gemakkelijker elektronen kunnen opnemen dan afstaan. De naam van de enkelvoudige niet-metaalionen eindigt altijd op '-ide'.
Hoe groot de negatieve lading van een niet-metaalion is, kun je afleiden uit het periodiek systeem. Zo hebben alle halogenen (groep 17) een lading van 1-. De niet-metalen uit groep 16 hebben een lading van 2- en die uit groep 15 een lading van 3-.
Voorbeelden
Cl− is het chloride-ion, O2− is het oxide-ion en N3− is het nitride-ion.
Naast de enkelvoudige negatieve ionen is er ook een zeer grote groep samengestelde negatieve ionen. Deze ionen bestaan uit groepjes atomen met een negatieve lading. De namen van deze ionen eindigt op '-iet' of '-aat'. Een voorbeeld is het sulfaation SO42−. Dit hele ion heeft dus een lading 2-. We bedoelen dus eigenlijk (SO4)2−.
In de onderstaande tabel staan enkele negatieve ionen vermeld.
| lading | negatieve ionen |
|---|---|
| 1− | H− (hydride-ion), F−, Cl−, Br−, I−, OH− (hydroxide-ion), NO2− (nitrietion), NO3− (nitraation), CH3COO− (acetaation), MnO4− (permanganaation), HCO3− (waterstofcarbonaation of bicarbonaation) |
| 2− | O2−, S2− (sulfide-ion), SO32− (sulfietion), SO42− (sulfaation), S2O32− (thiosulfaation), CO32− (carbonaation), CrO42− (chromaation), Cr2O72− (dichromaation), SiO32− (silicaation) |
| 3− | N3− (nitride-ion), P3− (fosfide-ion), PO43− (fosfaation) |
Naamgeving
De naam van een zout krijg je door de namen van het positieve en het negatieve ion achter elkaar te plaatsen.
Voorbeeld
Na2CO3 is natriumcarbonaat.
Voorbeeld
Fe(NO3)3 is ijzer(III)nitraat.
Formules
Hierboven hebben we al gebruik gemaakt van de wijze waarop je een zout kunt aangeven, namelijk door middel van een zogenoemde verhoudingsformule. In een zout zijn de positieve en negatieve ionen in een zodanige verhouding aanwezig, dat de stof als geheel neutraal van lading is.
Voorbeeld
Een zout bevat Ca2+-ionen en Cl−-ionen. Om evenveel pluslading als minlading te krijgen, moet de verhouding tussen de ionen 1:2 zijn. De verhoudingsformule wordt dus CaCl2.
Voorbeeld
Een zout bevat Al3+-ionen en SO42−-ionen. Om evenveel pluslading als minlading te krijgen, moet de verhouding tussen de ionen 2:3 zijn. De verhoudingsformule wordt dus Al2(SO4)3.
Binding in zouten
Als gevolg van de elektrische aantrekkingskracht tussen een positief en een negatief ion in een zout ontstaat een ionbinding. Een ionbinding is een zeer sterke binding.
Ionrooster
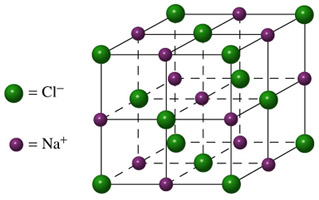
De wijze waarop de ionen in een zout in vaste toestand gerangschikt zitten, noemen we het ionrooster. In het ionrooster zijn ionen door ionen met een tegengestelde lading omringd. Immers, plus-plus en min-min stoten elkaar af terwijl plus-min en min-plus elkaar aantrekken.
In de figuur hieronder is het ionrooster van natriumchloride weergegeven.