Wat zijn valentie-elektronen?
Valentie-elektronen zijn de elektronen die zich bevinden in de buitenste schil van de elektronenwolk van een bepaald atoom. Valentie-elektronen zijn erg belangrijk omdat ze kunnen worden gebruikt voor het vormen van een chemische binding tussen atomen.
Het aantal valentie-elektronen bepaalt de bindingsmogelijkheden van een atoom. Een atoom heeft maximaal acht valentie-elektronen. Het precieze aantal valentie-elektronen kun je bepalen aan de hand van de positie van een atoom in het periodiek systeem.
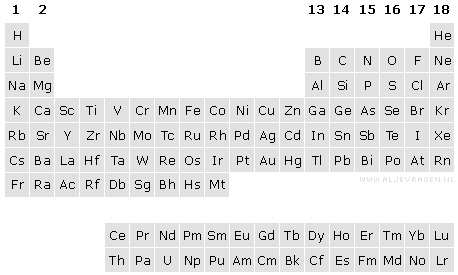
Alle atomen uit groep 1 van het periodiek systeem hebben dus één valentie-elektron en alle atomen uit groep 2 twee valentie-elektronen.
Alle atomen uit groep 13 hebben drie valentie-elektronen. De atomen uit groep 14 hebben vier valentie-elektronen enzovoort. Met uitzondering van helium heeft elk edelgasatoom (groep 18) acht valentie-elektronen. Maar omdat edelgasatomen vrijwel niet reageren met andere atomen, is het beter om te stellen dat een edelgasatoom nul valentie-elektronen heeft.
Voorbeeld
Arseen (As) staat in groep 15 en heeft dus vijf valentie-elektronen
De overgangsmetalen (groep 3 t/m 12) hebben een wisselend aantal valentie-elektronen.