Hoe werkt een destillatie?
Tijdens een destillatie wordt een mengsel van stoffen gescheiden op basis van een onderling verschil in kookpunt.
Voorbeelden
- het destilleren van sterke drank
- het destilleren van zeewater om drinkwater te krijgen
Destillatie-opstelling
Een eenvoudige destillatie-opzet die je tijdens een practicum tegen kunt komen ziet er als volgt uit:
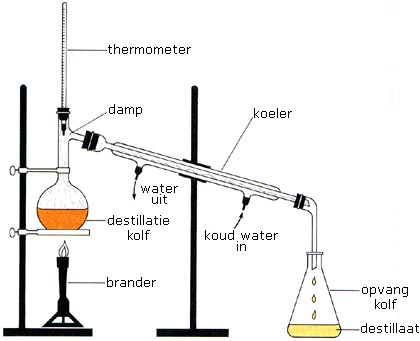
Stel je hebt een destillatiekolf met daarin een te scheiden mengsel van water (kookpunt 100 °C) en ethanol (kookpunt 78 °C). Door middel van een brander wordt de kolf langzaam verwarmd. Na enige tijd zal de stof met het laagste kookpunt (in dit geval ethanol) als eerste gaan koken. De ethanoldamp zal stijgen en via de thermometer bij de koeler aankomen. De damp zal condenseren en vervolgens in de opvangkolf terechtkomen. De vloeistof in de opvangkolf (hier de ethanol) wordt het destillaat genoemd. De vloeistof die in de destillatiekolf overblijft (hier het water) wordt het residu genoemd.
Tegenstroomprincipe
Een koeler in een destillatie-opstelling wordt over het algemeen gekoeld via het tegenstroomprincipe: het koudste water wordt aangesloten op de plaats waar de damp het minst warm is. Deze manier van koelen is het meest efficiënt.
Industrie
Destillatie is een veel gebruikte industriële scheidingsmethode. In een olieraffinaderij worden zo de verschillende bestanddelen (ook wel fracties genoemd) van ruwe olie van elkaar gescheiden.
 |
| Een typische industriële destillatiekolom. |