Wat is een waterstofbrug?
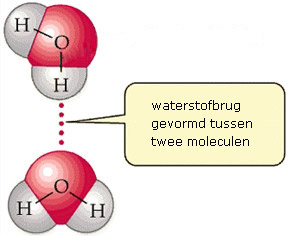
Een waterstofbrug is een voorbeeld van een intermoleculaire binding: het is een binding die plaatsvindt tussen moleculen. De moleculen waartussen een waterstofbrug kan voorkomen bevatten een waterstofatoom dat verbonden is aan een zuurstof- en/of stikstofatoom. Het H-atoom slaat als het ware een brug tussen twee moleculen.
Hieronder zijn enkele voorbeelden van stoffen weergegeven waarin waterstofbruggen (rode stippellijn) kunnen voorkomen: water (A), ammoniak (B) en methanol (C).
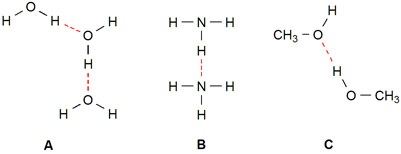
Een waterstofbrug treedt dus alleen op bij moleculen met O-H en/of N-H bindingen.
Opmerking: Waterstofbruggen kunnen ook voorkomen in waterstoffluoride (HF).
Het effect van waterstofbruggen
Waterstofbruggen zijn veel sterker dan vanderwaalsbindingen tussen moleculen. De mogelijkheid tot het vormen van waterstofbruggen heeft dan ook een groot effect op de eigenschappen van een stof.
Bij het smelten of koken van een stof worden de bindingen tussen moleculen verbroken. Als een molecuul waterstofbruggen kan vormen, is dit een extra kracht die bijvoorbeeld tijdens het koken dient te worden verbroken. Er is dus meer energie voor nodig om de stof te laten koken. Het resultaat is een hoger kookpunt dan je in eerste instantie zou verwachten.
Voorbeeld
H2S en H2O zijn twee soortgelijke stoffen met ongeveer dezelfde molecuulmassa. Te verwachten valt dat de stoffen ook ongeveer hetzelfde kookpunt hebben. H2S heeft een kookpunt van 213 K. H2O heeft echter een kookpunt van 373 K. Dit grote verschil wordt veroorzaakt doordat H2O waterstofbruggen kan vormen.