Wat is een atoombinding?
Een atoombinding (ook wel covalente binding genoemd) is een binding tussen twee niet-metaalatomen. De atoombinding wordt gevormd door een zogenoemd gemeenschappelijk elektronenpaar tussen de atomen: één elektron van een atoom vormt samen met één elektron van een ander atoom een elektronenpaar.
In een structuurformule wordt een atoombinding met een streepje aangegeven. Het aantal atoombindingen dat een atoom kan aangaan met een ander atoom noemen we de covalentie van een atoom.
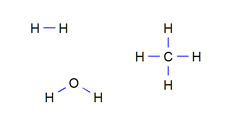 |
| In de bovenstaande structuurformules van waterstofgas, methaan en water zijn de atoombindingen in blauw aangegeven. |
Atoombindingen treden op bij moleculaire stoffen en zijn over het algemeen zeer sterk.
We maken een onderscheid tussen twee soorten atoombindingen:
- de gewone atoombinding - hierbij is (bijna) geen verschil in elektronegativiteit tussen de twee niet-metaalatomen (voorbeelden Cl-Cl en C-H)
- de polaire atoombinding - hierbij is een verschil in elektronegativiteit tussen de twee niet-metaalatomen (voorbeelden O-H, C-Cl en N-H)